鲁东大学农学院,山东烟台 264025
摘要:本研究采集了山东烟台地区的畸形平菇样品,提取样品总RNA,对进行了平菇球形病毒(OMSV)的RT-PCR检测,确认采集的平菇样品被OMSV感染。该研究对于OMSV的防控及研究平菇上病毒的群体动态和分子变异具有重要的意义,也为该领域的相关研究工作起到一定的推动作用。
关键词:平菇;平菇球形病毒;RT-PCR检测
1.前言
感染真菌的病毒称为真菌病毒(Mycovirus),大多数的寄主在感染真菌病毒对其表型没有显著的影响,因此常常不容易被及时发现。而引起食用菌种类发病的真菌病毒常常受到普遍关注。有些蘑菇在感染后不会表现出症状,然而,一些真菌病毒会引起宿主在形态和生理上的严重变化,例如生长速度、菌落形态、产孢量、色素和酶活性的变化等等[1-5]。早在1962年科研人员首次在双孢蘑菇上发现La France isometric virus (LIV) 能够引起双孢菇的菌丝生长异常和子实体畸形的症状[3],该病毒可能与双孢蘑菇上的另外一种病毒Mushroom bacilliform virus (MBV)一同引起双孢蘑菇La France病害[6]。最近韩国学者的研究表明感染双链RNA病毒Pleurotus ostreatus ASI2792 virus (PoV-ASI2792)的平菇,菌丝体的生长变慢,子实体的产量明显降低[7]。由此可见,食用菌病毒严重威胁到蘑菇的生产,而目前对于这些病毒病害的研究还比较少,防治显得尤为困难,因此对于食用菌病毒病害的检测、研究病毒的起源和进化、以及研究食用菌病毒致病的分子机理等生物学特性等研究显得尤为重要。
平菇球形病毒(OMSV)是一种侵染为害平菇的正单链RNA病毒,于2003年首先被韩国科学家发现并分离。OMSV病毒颗粒为球形,病毒粒子直径约为27 nm,基因组全长约为5.7 kbp,5’末端没有帽子结构,3’末端有多聚腺苷酸尾巴,编码7个开放阅读框(open reading frame,ORF)。目前已知其中两个ORF的编码产物,分别为病毒的外壳蛋白(coat protein,CP)和 RNA 依 赖 性 RNA 聚 合 酶(RNA-dependent RNA polymerase,RdRP),其他 ORF 编码的氨基酸序列与GenBank中已知的氨基酸序列没有同源性。平菇感染平菇球形病毒后,前期只是表现为菌丝生长速度减慢,出菇后才表现出菌柄肿胀呈漏斗或喇叭花状等朵形球状明显症状,因此难以做到及时防控,感染平菇的这些病毒可能使平菇的菌丝体生长不规则,子实体产生畸形并且严重降低平菇的产量,给菇农带来极大的经济损失。
本研究检测了采自山东烟台地区的畸形平菇样品,进行了OMSV的病毒检测,并且进行了核酸序列的比对分析。该研究对于研究各种病毒的群体动态和分子变异具有重要的意义,也为该领域的相关研究工作起到一定的推动作用。
2. 实验材料及方法
实验材料:随机采集烟台平菇栽培区的畸形平菇样品。
使用TIANGEN RNA提取试剂盒,按照说明书操作提取RNA。
反转录合成cDNA
反转录体系:
组分 | 体积 |
模板RNA | 2 μg |
3'引物(0.1 μg/μL) | 1 μL |
5 × M-MLV buffer | 3 μL |
dNTPs(各5 mM) | 0.5 μL |
M-MLV反转录酶(200 U/μL) | 0.2 μL |
RRI(40 U/μL) | 0.2 μL |
ddH2O | 补足到15 μL |
PCR扩增体系:
组分 | 体积 |
模板 | 3 μL |
5'引物(0.1 μg/μL) | 1 μL |
3’引物(0.1 μg/μL) | 1 μL |
2 ×Taq PCR Master Mix | 15 μL |
ddH2O | 补足到30 μL |
PCR扩增条件:
步骤 | 条件 |
预变性 | 94°C,5 min |
变性 | 94°C,30 s |
退火 | 50-60°C (Tm决定),30 s |
延伸 | 72°C,(1-2 kb/min) |
循环数 | 30-35 |
后延伸 | 72°C,5-10 min |
参考OMEGA凝胶回收试剂盒说明书:
紫外灯下切下目的DNA片段的琼脂糖胶块,将其放置于1.5 ml离心管中;
向管中加入500 μL 的结合buffer,在55°C加热块上加热,颠倒混匀几次,至胶完全熔化;
吸取融化的溶液,吸取并加到已置于2 ml离心管的DNA制备管中,12, 000 rpm离心60 s,弃滤液;
将制备管放回离心管,再次加500 μL 结合 buffer,8, 000 rpm离心45 s,将滤液弃掉;
将制备管放回离心管,加入700 μL 洗脱 buffer,12, 000 rpm离心30 s,将滤液弃掉;
重复步骤(5)
将制备管置于1.5 ml离心管上,加入30-50 μL ddH2O,室温静置2 min,12, 000 rpm离心2 min洗脱DNA。
组分 | 体积 | |
DNA片段 | 25 μL | |
10 × T4 DNA ligase buffer | 3 μL | |
pDM19-T载体 | 0.5-1 μL | |
T4 DNA ligase | 1.5 μL | |
ddH2O | 补足到30 μL | |
将大肠杆菌DH5α单菌落接种于2 ml LB液体培养基,37°C振荡培养过夜;
取1000 μL菌液接种于100 ml LB液体培养基,37°C振荡培养约2 hr,至OD600值为0.6左右;
在无菌条件下将菌液倒入50 ml 离心管中,4°C,4, 000 rpm,离心10 min,弃上清;
在无菌条件下加入25 ml 在4℃保存的无菌的0.1 M MgCl2-CaCl2溶液,混匀悬浮菌体,之后置于冰上30 min;
4°C,4, 000 rpm,离心10 min,弃上清;
在无菌条件下加入3 ml CaCl2(100 mM)吸吐悬浮菌体,冰上放置4 hr后备用。
取10 μL连接产物,加入100 μL大肠杆菌感受态细胞DH5α,冰浴30 min;
42°C水浴热激90 s,立即置于冰上,冰浴5 min;
加入400 μL LB液体培养基,37°C培养45-60 min;
将菌液涂布于含有相应抗生素的LB固体培养基上,等菌液吹干后,封上保鲜膜,37°C培养过夜。
3.实验结果
首先,在烟台的一些平菇栽培区采集表现畸形、呈喇叭花状并且子实体小的,疑似感染病毒的平菇样本,如图1所示,用于后续病毒病害的检测与分析。将采集的子实体样品用液氮研磨,利用TIANGEN 的RNA提取试剂盒提取样品总RNA,之后使用OMSV-1R作为反转录的引物,OMSV-1F/ OMSV-1R作为PCR反应体系的扩增引物对,扩增条件为:95℃预变性10 min,95℃变性30 s,53℃退火30 s,72℃延伸60 s,30个循环,最后72℃延伸5 min。PCR反应扩增产物利用1%琼脂糖凝胶进行电泳检测,阳性样品扩增片段大小约为700 bp。结果显示该体系可以检测到特异性OMSV的存在,检测条带单一,特异性比较好。


图 1疑似受病毒感染的平菇表现的症状
Fig 1. The symptoms of virus infecting Pleurotus ostreatus
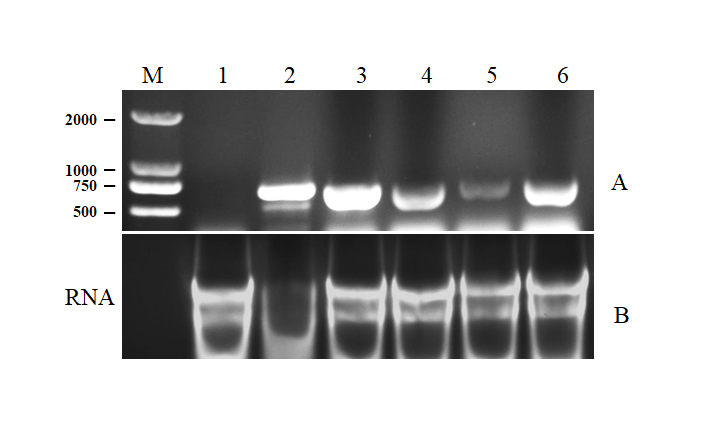
平菇球型病毒的RT-PCR检测(上图),引物对为OMSV-1F /OMSV-1R,M,GL DNA Marker2000,1 阴性对照,健康平菇样品,2-3疑似感染平菇球型病毒的平菇样品;电泳检测从各样品中提取的平菇总 RNA(下图B),RNA上样量为3 μL。
Fig 2. RT-PCR detection of OMSV on Pleurotus ostreatus
以cDNA为模板,利用引物对OMSV-1F/ OMSV-1R进行扩增,得到病毒部分核酸序列片段;PCR产物切胶回收后,连接pMD19-T载体,转化大肠杆菌DH5α感受态细胞;经菌落PCR筛选得到阳性克隆后,提取质粒送到上海生工公司进行测序。
用DNAMAN (Version 6.0, Lynnon Biosoft, Quebec, Canada) 和 Bioedit (Version 7.0.4.1)对平菇样本cDNA 扩增得到的核酸基因序列与已报道的OMSV 标准序列(NC_004560.1)的核酸序列进行比对分析,一致性为93%。
4.讨论
本实验对采自烟台的一些平菇栽培区采集表现畸形、呈喇叭花状并且子实体小的,疑似感染病毒的平菇样本,利用RT-PCR检测的方法对OMSV进行检测分析,确认采集的平菇样本被OMSV感染。并且其测得的核酸序列与已报道的OMSV 标准序列(NC_004560.1)的核酸序列高度同源。该研究对于研究各种病毒的群体动态和分子变异具有重要的意义,也为该领域的相关研究工作起到一定的推动作用。
(1) Song HY, Choi HJ, Jeong H, Choi D, Kim DH, Kim JM: Viral Effects of a dsRNA Mycovirus (PoV-ASI2792) on the Vegetative Growth of the Edible Mushroom Pleurotus ostreatus. Mycobiology 2016, 44(4):283-290.
(2) Son M, Yu J, Kim KH: Five Questions about Mycoviruses. PLoS Pathog 2015, 11(11):e1005172.
(3) Ghabrial SA, Castón JR, Jiang D, Nibert ML, Suzuki N: 50-plus years of fungal viruses. Virology 2015, 479-480:356-368.
(4) Dawe AL, Nuss DL: Hypoviruses and chestnut blight: exploiting viruses to understand and modulate fungal pathogenesis. Annu Rev Genet 2001, 35:1-29.
(5) Rigling D, Van Alfen NK: Extra- and Intracellular Laccases of the Chestnut Blight Fungus, Cryphonectria parasitica. Appl Environ Microbiol 1993, 59(11):3634-3639.
(6) Deakin G, Dobbs E, Bennett JM, Jones IM, Grogan HM, Burton KS: Multiple viral infections in Agaricus bisporus - Characterisation of 18 unique RNA viruses and 8 ORF ans identified by deep sequencing. Scientific reports 2017, 7(1):2469-2469.
(7) Song H-Y, Kim N, Kim D-H, Kim J-M: The PoV mycovirus affects extracellular enzyme expression and fruiting body yield in the oyster mushroom, Pleurotus ostreatus. Scientific reports 2020, 10(1):1094-1094.
作者简介:韩孟惠,女,本科生。
通讯作者:张晓艳,讲师,食用菌病虫害研究。