广东梅县东山中学 广东 梅州 514017
摘要:针对难溶电解质的溶解平衡知识部分,高中化学教材仅设置了“沉淀的溶解”和“沉淀的转化”两个部分演示实验,无“溶解平衡的移动”演示实验或实验设计验证效果不明显的不足,对该实验进行了重新设计。选用NaCl溶液与AgNO3溶液反应制得AgCl白色悬浊液,通过滴加氨水与Ag+反应形成Ag(NH3)2+,减小了Ag+浓度,得到沉淀溶解平衡正向移动,白色沉淀消失的现象;再向澄清后的溶液中滴加硝酸与Ag(NH3)2+反应形成NH4+和Ag+, Ag+浓度增大,溶液中重新产生大量白色浑浊。进而证明了AgCl白色悬浊液中存在溶解平衡,该难溶电解质的溶解平衡可以随对应离子浓度改变而发生平衡移动。
关键词:难溶电解质、溶解平衡、实验设计
沉淀溶解平衡属于人教版高中化学选择性必修1第三章第四节部分的知识内容,是化学平衡模型思想的应用拓展之一。难溶电解质的溶解平衡包括“溶解平衡”、“沉淀的溶解”和“沉淀的转化”三个方面的知识要点。但就人教版选修四教材中,相关的演示实验则只有“沉淀的溶解”和“沉淀的转化”两个部分,缺乏“溶解平衡的移动”的演示实验设计[1]。苏教版《化学反应原理》采用的是从PbI2悬浊液中检验出I–的实验设计,可证明PbI2的溶解,难以展现难溶电解质PbI2在水中的沉淀溶解平衡移动[2]。脱离了实验的验证与直观观察,学生对难溶电解质的溶解平衡知识的理解变得抽象、困难,教材演示实验设计的系统性也不够强。若能设计现象明显、操作简便、原理简单的“溶解平衡演示实验”, 对学生学习难溶电解质的溶解平衡和完善教材演示实验都能有一定的帮助。
1.实验目的
设计现象明显、操作简便、原理简单的难溶电解质的溶解平衡实验,便于学生直观观察难溶电解质的溶解平衡,加深对溶解平衡移动的理解。
2.实验仪器及药品
试管、胶头滴管、试剂瓶、试管架、0.1 mol/L NaCl溶液、0.1 mol/L AgNO3溶液、浓氨水(1:1比例)、2 mol/L 硝酸
3.实验原理
AgCl是一种难溶电解质,Ksp(AgCl)=1.77×10-10[3],在溶液中存在溶解平衡:AgCl(s) ⇌ Ag+(aq) + Cl–(aq)。当溶液中存在大量AgCl白色沉淀时,通过AgCl沉淀受到溶液中c(Ag+)变化而产生白色沉淀溶解和白色沉淀再次产生的现象,进而证明难溶电解质存在沉淀溶解平衡。实验设计见图1。
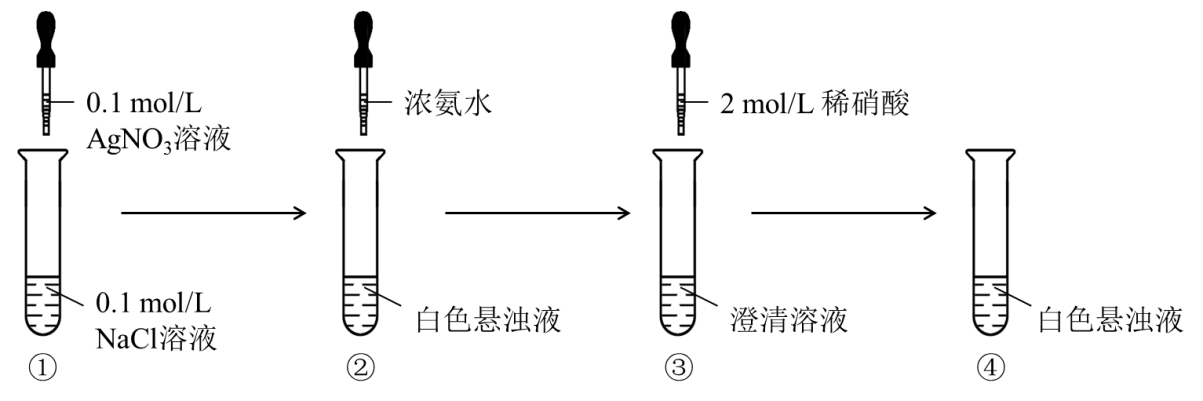
图1 AgCl的溶解平衡移动实验设计
步骤①:向2 mL 0.1 mol/L NaCl溶液滴加0.1 mol/L AgNO3溶液,生成AgCl白色沉淀,建立溶解平衡,由于溶液中存在浓度较大的Ag+和Cl–,AgCl的溶解平衡平衡:AgCl(s) ⇌ Ag+(aq) + Cl–(aq)逆向移动,溶液中出现白色浑浊。
步骤②:继续滴加浓氨水,Ag+与NH3发生络合反应:Ag+(aq) + 2NH3(aq) ⇌ Ag(NH3)2+(aq),导致Ag+浓度减小,AgCl的溶解平衡平衡:AgCl(s) ⇌ Ag+(aq) + Cl–(aq)正向移动,白色浑浊消失。
步骤③:继续滴加2 mol/L硝酸溶液,发生反应:NH3(aq) + H+(aq) = NH4+(aq),溶液中NH3浓度减小,平衡Ag+(aq) + 2NH3(aq) ⇌ Ag(NH3)2+(aq)逆向移动,溶液中Ag+浓度增大,AgCl的溶解平衡平衡:AgCl(s) ⇌ Ag+(aq) + Cl–(aq)逆向移动,溶液中再次出现白色浑浊。
通过实验,可以得出结论:难溶电解质的溶液中是存在溶解平衡的,随电解质溶液中对应离子浓度的变化,溶解平衡会发生正向或逆向移动,从而产生沉淀溶解或沉淀生成的现象。
4.实验过程
在洁净的试管中加入约2 mL 0.1 mol/L 的NaCl溶液,然后滴加2~3滴0.1 mol/L 的AgNO3溶液,观察现象;继续向所得混合液中逐滴滴加浓氨水,观察现象;再向所得混合液中逐滴滴加2 mol/L 稀硝酸溶液,观察现象。
表1 AgCl的溶解平衡移动
实验步骤 | 向2 mL 0.1 mol/L NaCl溶液中滴加2~3滴0.1 mol/L AgNO3溶液 | 继续向所得混合液中滴加浓氨水 | 继续向新得混合液中滴加2 mol/L 硝酸 |
实验现象 | 无色澄清溶液中出现 白色沉淀 | 白色沉淀溶解,溶液重新变为无色澄清 | 无色澄清溶液中又出现白色浑浊 |
结论 | 溶液中产生了AgCl白色沉淀 | AgCl白色沉淀 溶解消失 | 溶液中再次出现了AgCl白色沉淀 |
实验过程的现象变化见图2。

图2 AgCl的溶解平衡移动实验现象
5.实验设计的意义
电解质溶液的溶解平衡实验中,易溶性电解质溶液的溶解平衡现象在生产生活中比较容易观察,如向饱和NaCl溶液中滴加浓盐酸,c(Cl–)增大,溶液中产生大量白色NaCl沉淀。而难溶电解质的溶解平衡移动现象则较难观察,教材中也缺乏对应较好的实验设计。
李发顺[4]、邢泰宇[5]等设计了AgSCN的沉淀溶解平衡实验,采取向溶液中添加FeCl3溶液后,通过改变Ag+浓度观察溶液颜色的方案来观察AgSCN的沉淀溶解平衡。本实验设计与前者及苏教版教材实验设计相比,具有实验现象明显、说服力强,操作简便、实验试剂常规易得和原理简单的优点,便于学生观察实验,有利于加深学生对沉淀溶解平衡移动知识的理解。
参考文献:
[1] 范楼珍,吴海建主编.普通高中教科书.化学 选择性必修1 化学反应原理[M].北京:人民教育出版社,2020:77-83.
[2] 王祖浩主编.普通高中课程标准实验教科书.化学反应原理[M].南京:江苏教育出版社,2009:87.
[3] 北京师范大学无机化学教研室等编.无机化学.上册[M].北京:高等教育出版社,2002:419.
[4] 李发顺. 探究AgSCN沉淀溶解平衡的实验设计[J]. 化学教学, 2013(2):43-44.
[5] 邢泰宇. 沉淀溶解平衡实验设计及定量计算[J]. 实验教学与仪器, 2015, 32(3):35-35.