新乡医学院三全学院,河南省新乡 453003
摘要:目的 探讨全反式维甲酸(ATRA)对肺泡上皮细胞(AEC)向间质细胞转化(EMT)的影响及分子机制。方法 分离大鼠的AEC II进行原代细胞培养,取5~7代细胞分为正常对照组、5µg/L TGF-β1诱导组、10µmol/L ATRA组、5µg/L TGF-β1诱导+0.1µmol/L ATRA组、5µg/L TGF-β1诱导+1µmol/L ATRA组、5µg/L TGF-β1诱导+10 µmol/L ATRA组,37℃ 5% CO2条件下培养24h,RT-PCR方法检测细胞中Collagen III、α-SMA、JAK2、STAT3和SOCS3 mRNA水平,37℃ 5% CO2条件下培养72h,Western Blot检测细胞中α-SMA、JAK2、STAT3和SOCS3蛋白表达水平。结果 和空白组相比,TGF诱导组的α-SMA mRNA和蛋白表达水平均升高,Collagen III、JAK2、STAT3 mRNA水平显著升高,SOCS mRNA水平显著降低,JAK2、STAT3、pSTAT3蛋白水平均显著升高,差异有统计学意义(P<0.05);和TGF诱导组相比,TGF-β1诱导+10 µmol/L ATRA组和TGF-β1诱导+1 µmol/L ATRA组的α-SMA mRNA和蛋白表达水平均降低,Collagen III、JAK、STAT3 mRNA水平显著降低,SOCS mRNA水平显著升高,JAK2、STAT3、pSTAT3蛋白水平显著降低,差异有统计学意义(P<0.05)。结论 TGF-β1可诱导原代AEC向肺间质纤维细胞转化,ATRA可能通过JAK2/STAT3信号通路抑制肺纤维化EMT进程。
关键词:全反式维甲酸;JAK2;STAT3;肺泡上皮细胞;EMT
肺间质纤维化( PF)是多种间质性肺病的最终病理表现,临床特征为肺泡上皮细胞(AEC)损伤、成纤维细胞(FB)增殖及细胞外基质(ECM)沉积,导致肺结构不可逆重构,造成呼吸衰竭,具体的发病机制尚不明确[1-2]。近年来的研究显示上皮-间质转化(EMT)被认为是肺间质纤维化进程中的重要步骤[3],黄锋等[4]的研究显示人参皂苷Rg1能够改善博来霉素导致的肺间质纤维化程度,降低模型大鼠的肺系数,可能与其减少PDGF的表达有关。全反式维甲酸是维生素A在体内的活性代谢产物,影响细胞的增殖和分化,本研究中分离培养大鼠原代II型肺泡上皮细胞,探究全反式维甲酸对AEC II向间质细胞转化的影响及JAK2/STAT3信号通路在其中的作用。
1材料与方法
1.1材料
1.1.1动物与试剂
SPF级SD大鼠(新乡医学院三全学院动物实验中心提供)、1%戊巴比妥钠(Sigma)、DMEM培养基(Gibco公司)、PBS缓冲液、羊血清(Gibco)、胎牛血清(Gibco)、弹性蛋白酶(Sigma)、BSA(Roche),HRP标记羊抗兔(DAKO);RIPA裂解液、蛋白Marker、β-actin、BCA蛋白定量检测试剂盒均购自武汉谷歌生物科技有限公司;JAK2、STAT3、pSTAT3单克隆抗体,均购自美国Santa Cruz公司。
1.1.2仪器
离心机(美国赛默飞)、细胞培养箱(日本三洋公司)、倒置显微镜(Leica公司)、涡旋混合器(天悦电子)、电泳仪(北京六一仪器厂)、PCR扩增仪(美国 Bio-rad)、实时荧光定量PCR仪(美国赛默飞)。
1.2方法
1.2.1原代AEC的分离与培养
取体重约200g左右的健康大鼠,1%戊巴比妥钠腹腔注射麻醉后,0.9%生理盐水进行肺脏灌流,取得完全无血液残留的肺脏,用弹性蛋白酶消化,1000 r/min离心10min,取上清,通过免疫吸附法分离得到AEC,用DMEM培养液于5% CO2培养箱37 ℃培养,培养至5~7代将细胞接种于96孔板,104个/孔,培养24h。
1.2.2 PCR检测对JAK-STAT信号通路的影响
TGF-β1诱导24h后收集细胞,提取细胞总RNA并定量,逆转录的cDNA进行PCR扩增Collagen III、α-SMA、STAT3、SOCS3、GAPDH。PCR反应条件为:预变性,95℃ 5min;循环反应,95℃ 10s,60℃ 30s,40个;溶解曲线,95℃ 15s,60℃ 60s,95℃ 15s,以Ct值计算相对表达量。
1.2.3 WB检测对JAK-STAT信号通路的影响
TGF-β1诱导72h后收集细胞,以RIPA裂解液裂解细胞,2000rpm/min,4℃离心20min,BCA法测蛋白浓度后加入5×loading buffer和PBS稀释,100℃ 10min变性,制5%浓缩胶和10%分离胶,上样量为20µg,进行SDS-PAGE电泳,转膜,3% BSA封闭,Collagen III、α-SMA、STAT3、pSTAT3、SOCS3、GAPDH一抗(1:500)4℃孵育过夜,PBS洗涤,HRP标记的二抗(1:2000)室温孵育1h,加ECL发光液后显影,使用Quantity One软件进行灰度值测定。
1.3统计分析
使用SPSS 18.0进行数据的统计分析,计量资料以(均数±标准差)表示,组间进行One-way ANOVA分析,P<0.05认为差异有统计学意义。
2结果
2.1ATRA对肺纤维化EMT过程α-SMA表达的影响
和空白组相比,TGF诱导组的α-SMA mRNA和蛋白表达水平均升高,差异有统计学意义(P<0.05);和TGF诱导组相比,TGF-β1诱导+10 µmol/L ATRA组和TGF-β1诱导+1 µmol/L ATRA组的α-SMA mRNA和蛋白表达水平均降低,差异有统计学意义(P<0.05);和TGF诱导组相比,TGF-β1诱导+0.1 µmol/L ATRA组的α-SMA蛋白表达的水平降低,差异有统计学意义(P<0.05)。见图1和图2 。
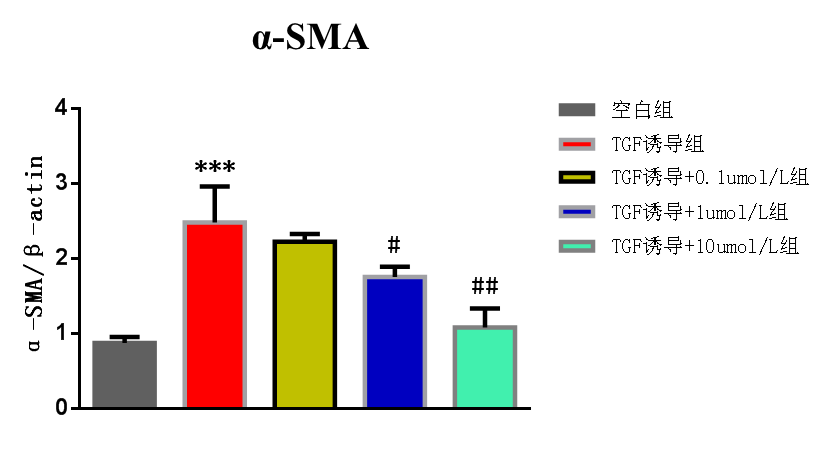
图1 ATRA对α-SMA mRNA水平的影响。***:和空白组相比,P<0.05;#:和TGF-β1诱导组相比,P<0.05;##:和TGF-β1诱导组相比,P<0.05。

图2 ATRA对α-SMA蛋白表达的影响。***:和空白组相比,P<0.001;##:和TGF-β1诱导组相比,P<0.01;###:和TGF-β1诱导组相比,P<0.001。
2.2 ATRA对Collagen III、JAK2、STAT3、SOCS mRNA水平的影响
和空白组相比,TGF-β1诱导组的Collagen III、JAK2、STAT3 mRNA水平显著升高,SOCS mRNA水平显著降低,差异均有统计学意义(P<0.05);和TGF-β1诱导组相比,TGF-β1诱导+10 µmol/L ATRA组和TGF-β1诱导+1 µmol/L ATRA组的Collagen III、JAK、STAT3 mRNA水平显著降低,SOCS mRNA水平显著升高,差异均有统计学意义(P<0.05);和TGF-β1诱导组相比,TGF-β1诱导+0.1 µmol/L ATRA组的STAT3水平显著降低,差异有统计学意义(P<0.05),见图3。
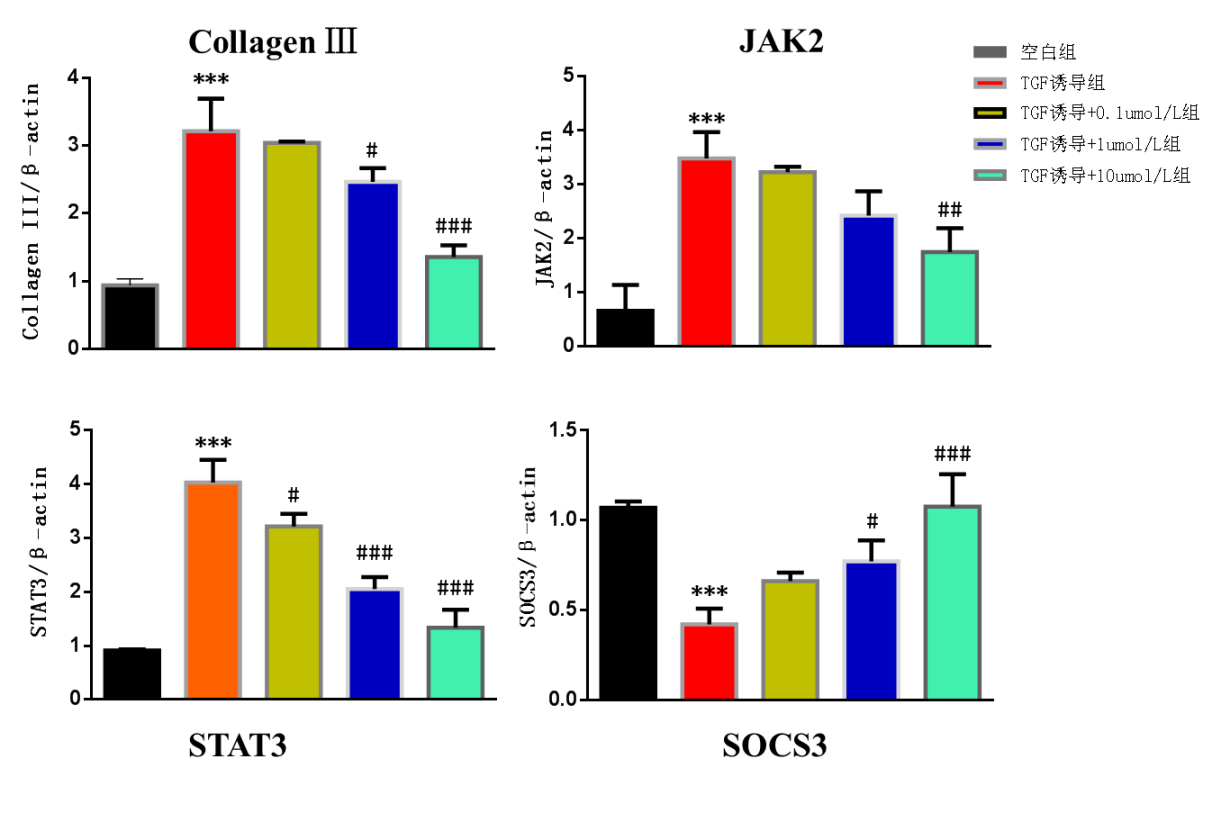
图3 ATRA对Collagen III、JAK2、STAT3、SOCS mRNA水平的影响。***:和空白组相比,P<0.001;#:和TGF-β1诱导组相比,P<0.05;##:和TGF-β1诱导组相比,P<0.01;###:和TGF-β1诱导组相比,P<0.001。
2.3 ATRA对JAK、STAT3、pSTAT3蛋白表达的影响
和空白组相比,TGF-β1诱导组的JAK2、STAT3、pSTAT3蛋白水平均显著升高,差异均有统计学意义(P<0.05);和TGF-β1诱导组相比,TGF-β1诱导+10 µmol/L ATRA组和TGF-β1诱导+1 µmol/L ATRA组的JAK2、STAT3、pSTAT3蛋白水平显著降低,差异均有统计学意义P<0.05);和TGF-β1诱导组相比,TGF-β1诱导+0.1 µmol/L ATRA组的JAK2水平显著降低,差异有统计学意义(P<0.05)。
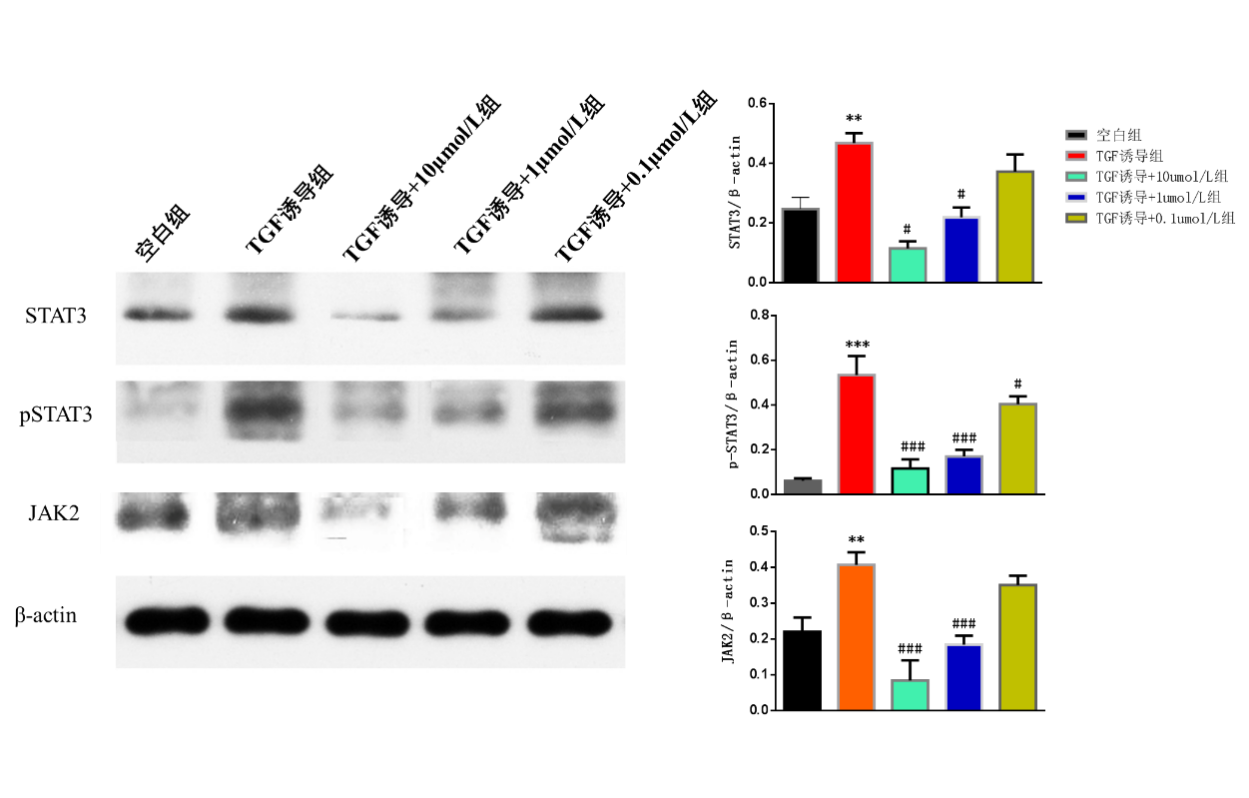
图4 ATRA对JAK2、STAT3、pSTAT3蛋白表达的影响。**:和空白组相比,P<0.01;***:和空白组相比,P<0.001;#:和TGF-β1诱导组相比,P<0.05;##:和TGF-β1诱导组相比,P<0.01;###:和TGF-β1诱导组相比,P<0.001。
3讨论
细胞外的多种信号通路均与肺纤维化相关,如Wnt信号通路、NF-kB信号通路、PI3K-AKT-mTOR信号通路、MAPK信号通路和TGF-β1信号通路,其中TGF-β1能够诱导肺泡上皮细胞、肝细胞、肾细胞等多种上皮细胞发生EMT,被认为是AEC转化为肺间质纤维细胞的关键因子,促进成纤维细胞的产生,参与上皮损伤后的修复和瘢痕的形成[5]。研究显示,TGF-β1可与细胞膜上受体结合,细胞内Smad2和Smad3磷酸化并形成聚合物,转移至细胞核内,增加下游α-SMA、基质金属蛋白酶等成纤维细胞特异性蛋白的表达,诱导肺间质纤维化发生[6]。本实验以大鼠的原代肺泡上皮细胞为研究对象,结果显示和空白组相比,TGF-β1诱导显著增加了α-SMA mRNA和蛋白质的表达水平,说明TGF-β1诱导能够显著增加AEC向肺间质纤维细胞的转化,即EMT过程。
ATRA影响包括肿瘤细胞等多种细胞的增殖与分化过程,目前认为可能是通过与维甲酸受体结合,进而调节基因表达发挥药理作用。本研究中TGF-β1诱导后原代肺泡上皮细胞的α-SMA mRNA和蛋白质表达水平升高,ATRA能够显著逆转α-SMA mRNA和蛋白质的改变,且效应随着剂量的增加而增强,说明ATRA能够逆转AEC向肺间质纤维细胞的转化。李佳鑫等
[7]研究显示,维甲酸可抑制人胚肺成纤维细胞系增殖和TGF-β1诱导的分化,与本研究结果一致。
3.2 ATRA对Collagen III、JAK2、STAT3、SOCS mRNA水平的影响
肺间质纤维细胞来源于肺组织间质固有成纤维细胞在多种细胞因子作用下的活化、骨髓的纤维细胞迁入、AEC向间质细胞转型(EMT)三种途径。正常情况下AEC参与修复正常的肺泡结构,而在肺纤维化过程中,AEC和炎症细胞释放并激活大量的细胞因子,包括TGF-β1、EGF、CTGF、PDGF、TNF-α和IL-1等,这些细胞因子都具有促纤维化作用,使得AEC失去上皮细胞的结构功能,而获得间质细胞的特性,发生EMT[8]。
研究显示在博莱霉素诱导的肺纤维化小鼠模型中出现EMT现象,气道上皮细胞和肺泡上皮细胞能向间充质细胞转化,参与肺纤维化病理过程[9]。肺纤维化过程中会导致组织间大量胶原沉积,本研究结果显示TGF-β1能够诱导AEC细胞Collagen Ⅲ mRNA水平显著升高,ATRA能降低诱导产生的Collagen Ⅲ mRNA,且效应随剂量增加而增加,说明ATRA能够抑制EMT。
JAK-STAT信号通路与许多疾病的发生相关,可被TNF-α、EGF、PDGF、CTGF等多种细胞因子和生长因子激活,在肺纤维化的病理过程中可能起重要的作用[10]。本研究结果显示TGF-β1能够诱导AEC细胞JAK mRNA和STAT3 mRNA水平显著升高,ATRA能降低诱导产生的JAK mRNA和STAT3 mRNA,且效应随剂量增加而增加。SOCS3是JAK/STAT信号通路的复兴调控因子之一,能够对抗STATs活化,负性调节多种细胞因子介导的信号通路,影响细胞的增殖、分化和凋亡[11]。本研究中TGF-β1能够诱导AEC细胞SOCS3 mRNA水平显著降低,ATRA能升高诱导产生的SOCS3 mRNA,且效应随剂量增加而增加,提示TGF-β1诱导导致SOCS3对JAK/STAT信号通路的抑制减弱,ATRA则能恢复SOCS3对JAK/STAT信号通路的抑制作用。
3.3 ATRA对JAK、STAT3、pSTAT3蛋白表达的影响
JAK2属于JAK蛋白家族,活化后可磷酸化STAT3,影响细胞生物学进程,是细胞膜信号传递到细胞核的重要途径[12]。TGF-β1等多种细胞因子均可与膜上受体结合,活化JAK2/STAT3信号通路,调控基因表达,影响细胞纤维化进程。JAK家族有JAK1、JAK2、JAK3和Tyk2四个成员,细胞因子与受体结合活化JAKs引发下游相应的STATs活化,马秀琴等[13]研究显示肺间质纤维化STAT1和STAT3大量异常表达,苦参碱可抑制JAK/STAT1和JAK/STAT3信号通路发挥抗纤维化作用。
为进一步验证JAK2/STAT3信号通路在EMT过程中的作用,我们通过蛋白质免疫印迹法对JAK2、STAT3、pSTAT3蛋白表达水平进行检测,结果显示TGF-β1能够诱导AEC细胞中JAK2、STAT3和pSTAT3蛋白表达,ATRA能够逆转诱导升高的JAK2、STAT3和pSTAT3蛋白表达,效应随剂量增加而增强,说明ATRA可能通过抑制JAK2/STAT3信号通路进减少AEC细胞向肺间质细胞转化。糖皮质激素和免疫抑制剂是肺纤维化的传统治疗手段,主要针对炎症改变为主的早期肺纤维化和间质性肺疾病,ATRA能够显著降低胶原蛋白等细胞外基质的产生,为肺间质纤维化病变的治疗提供新的思路和方法,本研究发现ATRA可能通过JAK2/STAT3信号通路改善肺间质纤维化,为ATRA的临床应用提供理论基础。
参考文献
[1] Wolters PJ, Collard HR, Jones KD. Pathogenesis of idiopathic pulmonary fibrosis[J]. Annu Rev Pathol. 2014,9:157-79.
[2] Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology[J]. Eur Respir J. 2010, 35(3):496-504.
[3] 疏欣杨,李得民,韩春生,阮越勇,刘剑,张纾难.上皮-间质转化在肺间质纤维化中的作用及中药干预机制研究进展[J].中华中医药杂志,2017,32(08):3635-3638.
[4] 黄锋,孙娟,杨智华,贾岩龙,邵焕霞,刘会茹,詹合琴.人参皂苷Rg1灌胃对大鼠特发性肺间质纤维化的治疗作用及其机制探讨[J].山东医药,2017,57(27):40-42.
[5] 韩姣,曾凡军,陈世雄.上皮间质转化相关信号通路在肺纤维化发生发展中的作用[J].山东医药,2015,55(17):101-103.
[6] Madne TH, Dockrell MEC. TGFβ1-mediated expression and alternative splicing of Fibronectin Extra Domain A in human podocyte culture[J]. Cell Mol Biol (Noisy-le-grand). 2018, 28;64(3):17-24.
[7] 李佳鑫,海广范,贾岩龙,夏武,陈永凤,刘巨源.全反式维甲酸对人胚肺成纤维细胞增殖及α-SMA表达的影响[J].中国病理生理杂志,2011,27(04):787-790.
[8] 郭迎科,李瑞琴,丁玉文.肺纤维化发病机制的细胞因子研究进展[J].亚太传统医药,2016,12(19):69-72.
[9] 陈华,张柏盛,龙小平.吴茱萸次碱对博来霉素诱导大鼠肺纤维化的影响[J].中药材,2020(12):3024-3028.
[10] O'Shea JJ, Schwartz DM, Villarino AV, Gadina M, McInnes IB, Laurence A. The JAK-STAT pathway: impact on human disease and therapeutic intervention[J]. Annu Rev Med. 2015, 66:311-28.
[11] Durham GA, Williams JJL, Nasim MT, Palmer TM. Targeting SOCS Proteins to Control JAK-STAT Signalling in Disease[J]. Trends Pharmacol Sci. 2019, 40(5):298-308.
[12] Li CH, Xu LL, Zhao JX, Sun L, Yao ZQ, Deng XL, Liu R, Yang L, Xing R, Liu XY. CXCL16 upregulates RANKL expression in rheumatoid arthritis synovial fibroblasts through the JAK2/STAT3 and p38/MAPK signaling pathway[J]. Inflamm Res. 2016, 65(3):193-202.
[13] 马秀琴,陈如华,刘秀芳,谢婧,史可云,端礼荣.苦参碱对肺间质纤维化JAKs/STATs通路的影响[J].中国医院药学杂志,2014,34(08):629-633.
基金项目:河南省高等学校重点科研项目计划(项目编号:8A310027)