信息产业电子十一设计研究院科技工程股份有限公司 江苏省南京市雨花台区 邮编210000
摘 要 通过对mRNA 疫苗工艺的理解,本文探讨了厂房工艺工程设计要点,提出了一个mRNA疫苗中试厂房的工艺方案。
关键词 mRNA疫苗 厂房设施设计 工艺平面
在过去的三年中,由于新冠疫情,我们目睹了疫苗研究和制造活动的爆炸式增长,范围从细胞分泌体到AAV载体疫苗,到病毒抗原的mRNA脂质纳米颗粒。虽然传统平台仍在使用,但创新的疫苗递送系统正在崛起。
针对传染性病原体开发预防性疫苗是控制和阻止流行病大规模爆发的关键。传统的疫苗通常建立在整个病毒株的基础之上,包括减毒疫苗、灭活疫苗,也有基于病毒蛋白亚单位的重组蛋白疫苗。虽然这些传统疫苗在许多疾病的预防上起到了重要作用,但是面对急性爆发的传染病,例如此次的新型冠状病毒,传统疫苗的研发和生产周期太长,难以满足控制疫情的需要,因此需要更加有效、更加通用的疫苗开发平台。
1 什么是mRNA疫苗
mRNA疫苗是一种新型疫苗,旨在预防传染病和慢性病。许多经典疫苗将分离的天然或重组抗原组装体引入我们的体内以引发免疫反应。但是mRNA疫苗是对我们的细胞进行编程以制造一种蛋白质,再通过蛋白质来触发免疫反应。例如,COVID-19 mRNA疫苗使用mRNA编码一种称为“刺突蛋白”的无害COVID-19病毒成分的多个免疫原性表位。疫苗在载体中将mRNA递送到我们的细胞。在粒子传递mRNA后,我们的细胞产生刺突蛋白抗原分解mRNA,并在其表面展示蛋白质,我们的免疫系统将其识别为外来物,并建立针对它的免疫反应。
信使核糖核酸(messenger RNA,mRNA)疫苗具有很多得天独厚的优势。容易制备是mRNA疫苗脱颖而出的主要原因之一。因为其活性成分RNA形式简单,通常以线性DNA为模板通过体外转录获得。在这个过程中可通过密码子优化、核苷修饰、以及辅助递送系统等方式可提高mRNA的稳定性及翻译效率,从而形成特异性高、稳定性强的核酸疫苗。mRNA疫苗具有安全性高、均衡免疫性好、研发周期短、生产成本低等优势,mRNA抗体比其他形式递送的抗体在体内发挥生物学效应的时间更早也更持久。
新型药物疗法的发展与成熟离不开新的工艺和生产解决方案的支持。本文根据mRNA 疫苗产业化生产工艺特点,以及相关法规要求,探索中试厂房工艺设计,给出一个参考方案。
2 工艺平面的探讨
mRNA药物的生产工艺包括质粒DNA原液制备、mRNA原液制备(DS)和mRNA制剂制备(DP)这三大生产环节。
质粒DNA的生产从复苏的菌种开始,经过多级扩增培养,以达到生产规模培养所需的菌种数量。然后按所需生产规模进行生产发酵培养,使质粒DNA达到足够的复制数量,以满足最终质粒产量的要求。
在菌种扩增和生产发酵阶段需要用到的设备耗材相对来说都是比较传统的产品,在行业内有较成熟的供应体系,可选项比较多,竞争较为激烈,国产厂家也不少。线性化并纯化后的质粒DNA需配制成适合冷冻保存的配方原液,再经除菌过滤并无菌分装至适合冷冻保存的容器中。
本文主要阐述mRNA原液制备、mRNA制剂制备的生产车间布局,质粒DNA原液制备、QC及仓储受篇幅限制不在此讨论。
2.1 mRNA原液制备
2.1.1 工艺概述及流程

图1 mRNA原液制备工艺流程
体外转录(IVT)和修饰过程涉及多个步骤,包括转录、5’端加帽、3’端加Poly(A)尾、去磷酸化等步骤。mRNA核苷酸修饰、加Poly(A)尾通常在转录过程中进行,加帽反应可在转录过程中进行,也可作为单独步骤在转录完成后进行。mRNA 原液制备目前并没有成熟、标准化的工艺生产路线,已上市或在研产品可能采用不同的上、下游技术[1]。总之,mRNA的修饰非常重要,设计良好的mRNA修饰结构有助于提高其稳定性和翻译效率、延长半衰期、降低免疫原性等。因为目前mRNA 原液生产路线不固定,因此,现阶段的工艺平面设计要保持一定的灵活性,以满足未来可能出现的不同工艺路线的要求。
2.2 mRNA制剂制备
2.2.1 工艺概述及流程
LNP封装:纯化后的mRNA与脂质体在微流体混合器中混合,随后过滤、灌装。
以当前主流的微流控混合技术来说,Pfizer/BioNTech采用的是冲击式射流混合器,mRNA溶于偏酸性水相,脂质体溶于乙醇,通过高压使mRNA溶液与脂质体溶液形成两股射流对冲混合,强烈的湍流使各组分充分混合,同时乙醇相被稀释,溶液pH变化,脂质体析出形成脂质纳米颗粒并与mRNA形成包封复合物。
对于无菌注射剂产品,灌装技术需根据产品包装容器来选择。以mRNA疫苗所用西林瓶为例,无菌灌装过程包括容器和胶塞的准备、灌装、加塞、轧盖、灯检等步骤。
2.3 工程设计要点分析
mRNA原液制备和制剂制备生产设施设计时,需要注意以下几点:
物流:mRNA
原液的生产过程钟涉及到多步纯化,因此缓冲液的配制和暂存要尽量靠近使用点。
防爆:脂质体的制备过程中需要使用乙醇,要注意土建和机电的防爆设计,同时防爆房间的面积需要控制。
生物安全:mRNA的整个生产过程涉及到的活体微生物只有大肠杆菌,所以生物安全等级为Ⅰ级。
2.4工艺平面布置
mRNA DS 生产车间与mRNA DP车间相对独立,mRNA DS 生产车间核心操作间包括IVT间、纯化间,配液间与纯化间邻近,方便使用。同时也设置了清洗灭菌、中间过程控制及物料暂存等辅助功能间。
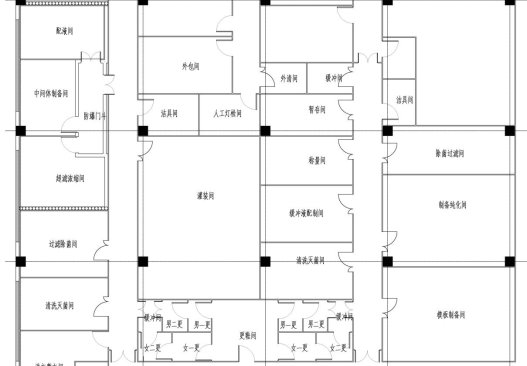
图2 mRNA疫苗中试车间工艺平面布置图
mRNA 原液为最终可无菌过滤的产品,它的生产区域按照C 级洁净级别设计。在进出口设置人员及物料气闸间。人员经过更衣后进入C 级生产区走廊,然后进入各功能间。
此方案中的mRNA 制剂车间采用C+隔离器的方案,因此生产区域也按照C级洁净区设计。另使用到较大量乙醇的工段需考虑防爆。
3结语
mRNA疫苗虽具有广阔的前景,但同时也面临诸多转化痛点。目前仅有Moderna 公司和BioNTech/Pfizer 公司的mRNA 新冠疫苗获得FDA紧急使用授权,国产mRNA 疫苗仍处于临床阶段,国内尚无监管案例可循[2]。因此mRNA疫苗厂房工艺设计既要具有前瞻性,可以满足潜在工艺路线以及产能需求,又要防止过度设计导致初期投资过高。
参考文献
[1] ROSA S S, PRAZERES D M F, AZEVEDO A M, et al.mRNA vaccines manufacturing:challenges and bottlenecks[J].Vaccine, 2021, 39(16): 2190-2200.
[2] 孙程洁, 成 殷, 王 冲.mRNA 疫苗的研究进展及监管概述[J].中国药事, 2022, 36(1): 3-9.